EMR
MUCOSECTOMIA ENDOSCOPICA (EMR)
E’ una tecnica particolare di RESEZIONE ENDOSCOPICA della MUCOSA (EMR) cioè di rimozione di tessuto mucoso e sottomucoso con esposizione della muscolare propria. La mucosectomia è stata utilizzata in Giappone dal 1984 per asportare gli EARLY CANCER del tratto gastro-intestinale. La EMR è indicata quando la lesione neoplastica (bene differenziata e con margini di resezione indenni) NON HA ancora invaso la MUSCOLARE PROPRIA e quando il RISCHIO di LINFONODI METASTATICI è ASSENTE. La mucosectomia endoscopica (EMR) è considerata il metodo di scelta per l’asportazione dei polipi piatti del tratto gastrointestinale. Uno dei vantaggi dell’EMR è di essere meno invasiva della chirurgia tradizionale, di avere meno rischi e meno complicanze (figura 1).
Tuttavia ha lo svantaggio di non poter asportare en bloc lesioni polipoidi > 20 mm con un aumentato rischio di tessuto adenomatoso residuo e di recidiva, e minore accuratezza dell’esame istologico in caso di asportazione piece-meal (1). Un’alternativa all’EMR per lesioni > di 2 cm è la tecnica giapponese nota come dissezione endoscopica sottomucosa (ESD) che permette un’asportazione della lesione en bloc eliminando i limiti dell’asportazione in piece-meal. Un’alternativa a queste due tecniche, che si sta diffondendo soprattutto in Occidente, consiste in un “ibrido” tra EMR e ESD. La combinazione delle due procedure, riduce i tempi dell’ESD e le complicanze, riuscendo comunque ad ottenere un unico frammento per l’esame istologico, riducendo il rischio di recidiva. Di seguito discuteremo la prospettiva occidentale e orientale rispetto alle indicazioni all’EMR ed ESD, le problematiche legate alla tecnica e le aree di ricerca future.
Tecnica di EMR
La EMR è una tecnica ampiamente utilizzata in endoscopia, considerata procedura sicura, efficace e minimamente invasiva per l’asportazione di lesioni esofagee, gastriche e del colon-retto. Le tecniche che descriveremo in seguito hanno tutte in comune prima il distacco della mucosa dagli strati profondi, che può avvenire mediante iniezione di liquidi nella sottomucosa e/o aspirazione, quindi formazione di uno pseudo-polipo mediante aspirazione (cap-assisted EMR) o posizionamento di un elastico (banding-tecnique), quindi resezione della lesione mediante ansa. Esiste anche la tecnica “inject and cut”, comunemente utilizzata per le lesioni coliche che richiede semplicemente l’infiltrazione di una lesione prima della asportazione endoscopica. Tale tecnica si può utilizzare anche in lesioni più grandi di 2 cm mediante tecnica piecemeal ma presenta un elevato rischio di recidiva.
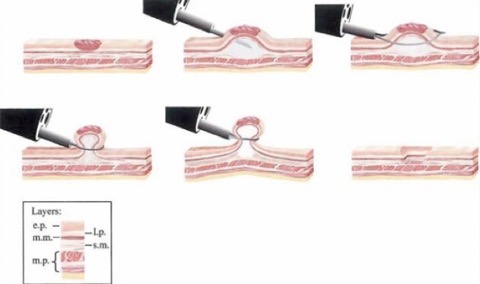
EMR con tecnica del “lift and cut”



Cap-assisted EMR o tecnica del “suck and cut”
Efficacia di EMR/ESD e complicanze
I primi reports sui risultati dell’ESD in Occidente nel trattamento dell’EGC furono pubblicati nel 2009. In uno studio italiano, Catalano et al hanno confrontato i risultati dell’EMR e dell’ESD per il trattamento dell’EGC. In una casistica di 36 EMR vs 12 ESD, all’esame istologico il 92% di ESD aveva margini liberi da malattia vs 56% di EMR; non è stata rilevata recidiva di neoplasia in nessuno dei due gruppi (follow-up medio di 31 mesi) con un solo caso di perforazione e sanguinamento (8). Dinis-Ribeiro et al, in uno studio portoghese, hanno riportato un caso di recidiva in 19 pazienti dopo 10 mesi di follow-up, con un 78% di asportazione en bloc con ESD, un solo caso di sanguinamento, senza perforazioni (9). Emura et al, hanno invece riportato in forma di abstract, uno studio su 9 pazienti: 100% di asportazione en bloc, 78% di margini liberi di resezione e nessuna complicanza (2,10). Ci sono reports sull’utilizzo dell’ESD anche per il trattamento di neoplasie squamose dell’esofago e i risultati dell’ESD sono migliori della EMR sia in Oriente che in Occidente anche in questo tipo di lesione. Uno studio retrospettivo di Takahashi et al condotto su 300 pazienti, ha mostrato un numero maggiore di lesioni con margini liberi da malattia nel gruppo ESD vs EMR (97% vs 78%). È stata riportata anche una minore recidiva (0.9% in ESD vs 9.8% in EMR) e uguali complicanze (11). Repici et al, in occidente, hanno pubblicato i risultati di uno studio prospettico condotto su 20 pazienti con resezione en bloc con margini liberi da malattia nel 90% dei casi; in 2 casi hanno riportato tuttavia enfisema sottocutaneo (12). Saito et al hanno pubblicato su 373 lesioni colorettali di grandi dimensioni una minore recidiva nel gruppo di ESD vs EMR (2% vs 14%) ma una percentuale maggiore di perforazioni (6.2% vs 1.3%) senza differenza nei tempi di procedura (1). Recentemente Kobayashi et al hanno riportato uno studio caso-controllo confrontando 28 lesioni colorettali trattate ESD con 56 lesioni trattate con EMR. La rimozione en bloc è significativamente maggiore nel gruppo ESD (92.9% vs 37.5%) con una percentuale di recidiva pari a 0%; tuttavia il tempo medio di procedura e il numero di perforazioni era maggiore nel gruppo di ESD (13). Analogamente una metanalisi di Cao et al ha mostrato che l’ESD risultava più efficace e con una percentuale di recidiva minore rispetto all’EMR ma richiedeva tempi superiori e comportava un maggiore numero di complicanze (sanguinamento e perforazione) (14). Recentemente Hotta et al hanno condotto uno studio sul ruolo dell’ESD nel trattamento di “laterally spreading tumors non-granular type (LST-NG)” del colon-retto senza evidenza di metastasi linfonodali (15). Anche Shi et al hanno pubblicato una casistica di 28 pazienti con 30 lesioni esofagee coinvolgenti la muscolaris propria trattati con ESD riportando durata media di procedura di 73.5 minuti, 93.3% di en bloc resection e il 100% di trattamento curativo. Nessuna recidiva è stata evidenziata dopo un follow-up medio di 27 mesi (16). Tutti questi studi mostrano la superiorità dell’ESD vs EMR nelle lesioni gastriche, esofagee e coliche “early” in termini di margini liberi da malattia, en bloc resection e recidiva di malattia. Tuttavia ad oggi i tempi di esecuzione della procedura sono ancora molto lunghi e con un’elevata percentuale di complicanze.
Tecniche alternative
Il numero limitato di ESD per l’EGC in Occidente è dovuto soprattutto alla minore incidenza di tale patologia (17). L’elevata incidenza di neoplasia gastrica in Oriente ha portato ad implementare i programmi di screening e di sorveglianza e di conseguenza a poter sviluppare e migliorare la tecnica di ESD. Al contrario, gli endoscopisti occidentali hanno dovuto “affiancare” i colleghi Orientali nella procedura o effettuare lunghi training su modelli animali (maiali) per raggiungere l’esperienza necessaria e sufficiente (17). A causa di questi limiti sono state sviluppate tecniche alternative “ibride”, come la circumferential submucosal incision endoscopic mucosal resection (CSI-EMR), e la hybrid-knife ESD. La CSI-EMR consiste nell’iniezione sottomucosa di soluzione liquida, seguita dall’incisione circonferenziale utilizzando un needle-knife, quindi dalla rimozione della lesione en bloc con ansa diatermica. In un recente studio australiano di Moss et al condotto su modelli animali, in lesioni sessili del colon con diametro medio di 40 mm, la CSI-EMR si è dimostrata superiore alla EMR en bloc in termini di percentuale di rimozione e complicanze (6). Un altro studio di Sakamoto et al, condotto su lesioni di diametro tra 20-40 mm, ha mostrato l’efficacia di una tecnica simile nell’asportazione en bloc in termini di tempi di procedura, decisamente ridotti rispetto all’ESD, ma anche il numero di complicanze risulta inferiore (18). I vantaggi dell’incisione circonferenziale sono molteplici: ridotto rischio di tessuto residuo e di recidiva, semplicità della tecnica per un endoscopista esperto e un unico pezzo istologico (18). Un’altra tecnica di ESD, descritta recentemente da Moss et al, che utilizza un Hybrid-knife combinando l’effetto dell’iniezione sottomucosa con incisione con elelettro-cauterio (ESDH si è dimostrata superiore a CSI-EMR nell’asportazione di lesioni > 50 mm en bloc sempre su modelli animali (19), sicura e più rapida della tecnica convenzionale di dissezione sottomucosa.
Prospettive
Tra le limitazioni della ESD in Occidente, oltre al ridotto numero di casi c’è la disponibilità di risorse per definire se una lesione è eligibile a trattamento con ESD o no. La cromoendoscopia e la magnificazione sono due tecniche routinariamente utilizzate in Giappone per studiare la vascolarizzazione di superficie, il pit pattern, il tipo e la profondità della lesione ma non sono utilizzate in Occidente, se non in casi selezionati. Inoltre i modelli animali, utilizzati all’inizio per il training degli endoscopisti sono molto costosi. Nonostante tutte queste limitazioni, la ESD sta comunque acquisendo una popolarità crescente anche in Occidente. Un panel di esperti ha raccomandato la partecipazione a corsi strutturati con approccio graduale all’ESD, partendo da lesioni localizzate al retto, quindi allo stomaco distale, colon, fondo gastrico e quindi all’esofago (20). Il training sulle lesioni del retto è stato proposto in Occidente come primo step, sia per la sicurezza della tecnica che per la disponibilità di lesioni asportabili endoscopicamente con conseguente maggiore possibilità di training. Viene inoltre raccomandato di assistere ad almeno 15 ESD “live procedure” eseguite da un esperto, seguite da esercitazioni pratiche su modelli animali e modelli di stomaco isolato, prima di eseguire la procedura su pazienti (20).
In conclusioni la EMR e la ESD sono considerate entrambe efficaci e valide alternative alla chirurgia quando clinicamente indicate, in particolare l’ESD è vantaggiosa per resecare lesioni > 20 mm en bloc. Le resezioni en bloc efficaci sono quelle che presentano i margini verticali e orizzontali “liberi da malattia” e quelle che permettono il più accurato esame istopatologico. Il rischio di metastasi linfonodali e l’invasione profonda della neoplasia sono i più importanti criteri per determinare se la lesione è suscettibile o meno di trattamento endoscopico.
Bibliografia
- Saito Y, Fukuzawa M, Matsuda T et al. Clinical outcome of endoscopic submucosal dissection versus endoscopic mucosal resection of large colorectal tumors as determined by curative resection. Surg Endosc 2010 Feb;24(2):343-352.
- Othman MO, Wallace MB. Endoscopic mucosal resection (EMR)
and endoscopic submucosal dissection (ESD) in 2011, a Western perspective. Clin Res Hepatol Gastroenterol 2011 Apr;35(4):288-294. - Japanese Gastric Cancer A. Japanese Classification of Gastric Carcinoma – 2nd English Edition. Gastric Cancer 1998 Dec;1(1):10-24.
- Ahn JY, Jung HY, Choi KD et al. Endoscopic and oncologic outcomes after endoscopic resection for early gastric cancer: 1370 cases of absolute and extended indications. Gastrointest Endosc 2011 Sep;74(3):485-493.
- Soetikno R, Kaltenbach T, Yeh R, Gotoda T. Endoscopic mucosal resection for early cancers of the upper gastrointestinal tract. J Clin Oncol Jul 10 2005;23(20):4490-4498.
- Moss A, Bourke MJ, Tran K et al. Lesion isolation by circumferential submucosal incision prior to endoscopic mucosal resection (CSI- EMR) substantially improves en-bloc resection rates for 40-mm colonic lesions. Endoscopy. May 2010;42(5):400-404.
- Tanaka S, Oka S, Chayama K. Colorectal endoscopic submucosal dissection: present status and future perspective, including its differentiation from endoscopic mucosal resection. J Gastroenterol 2008;43(9):641-651.
- Catalano F, Trecca A, Rodella L et al. The modern treatment of early gastric cancer: our experience in an Italian cohort. Surg Endosc 2009 Jul;23(7):1581-1586.
- Dinis-Ribeiro M, Pimentel-Nunes P, Afonso M, Costa N, Lopes C, Moreira-Dias L. A European case series of endoscopic submucosal dissection for gastric superficial lesions. Gastrointest Endosc Feb 2009;69(2):350-355.
- Emura F, Ricuarte O, Mejia J et al. ESD for Early Gastric Cancer in Colombia. A Western Validation of the Japanese Experience. Gastrointest Endosc 2009;69(5):AB178.
- Takahashi H, Arimura Y, Masao H et al. Endoscopic submucosal dissection is superior to conventional endoscopic resection
as a curative treatment for early squamous cell carcinoma
of the esophagus (with video). Gastrointest Endosc 2010 Aug;72(2):255-264,264 e251-252. - Repici A, Hassan C, Carlino A et al. Endoscopic submucosal dissection in patients with early esophageal squamous cell carcinoma: results from a prospective Western series. Gastrointest Endosc 2010 Apr;71(4):715-721.
- Kobayashi N, Yoshitake N, Hirahara Y et al. A Matched Case- control Study Comparing Endoscopic Submucosal Dissection and Endoscopic Mucosal Resection for Colorectal Tumors. J Gastroenterol Hepatol 2011Oct;17.
- Cao Y, Liao C, Tan A, Gao Y, Mo Z, Gao F. Meta-analysis of endoscopic submucosal dissection versus endoscopic mucosal resection for tumors of the gastrointestinal tract. Endoscopy 2009 Sep;41(9):751-757.
- Hotta K, Saito Y, Fujishiro M et al. Impact of endoscopic submucosal dissection for the therapeutic strategy of large colorectal tumors. J Gastroenterol Hepatol 2012 Mar;27(3):510-515.
- Shi Q, Zhong YS, Yao LQ, Zhou PH, Xu MD, Wang P. Endoscopic submucosal dissection for treatment of esophageal submucosal tumors originating from the muscularis propria layer. Gastrointest Endosc. Dec 2011;74(6):1194-1200.
- Bourke M. Current status of colonic endoscopic mucosal resection in the west and the interface with endoscopic submucosal dissection. Dig Endosc Jul 2009;21 Suppl 1:S22-27.
- Sakamoto T, Matsuda T, Nakajima T, Saito Y. Efficacy of endoscopic mucosal resection with circumferential incision for patients with large colorectal tumors. Clin Gastroenterol Hepatol Jan 2012;10(1):22-26.
- Moss A, Bourke MJ, Metz AJ et al. Beyond the snare: technically accessible large en-bloc colonic resection in the West: an animal study. Dig Endosc 2012 Jan;24(1):21-29.
- Deprez PH, Bergman JJ, Meisner S et al. Current practice with endoscopic submucosal dissection in Europe: position statement from a panel of experts. Endoscopy 2010 Oct;42(10):853-858